코로나19 백신 및 치료제 어떤 절차 걸쳐서 승인되나?
페이지 정보

본문
[오행생식 송새눈 기자] 코로나19가 올해도 지속될 것이라는 전망이 나오고 가운데 치료제·백신에 대한 국민적 관심이 높아지고 있다. 특히 국내 백신 치료제 현황과 국내외 백신이 어떠한 절차를 거쳐서 안전하게 승인되는지에 대한 궁금증도 더해지는 상황이다.
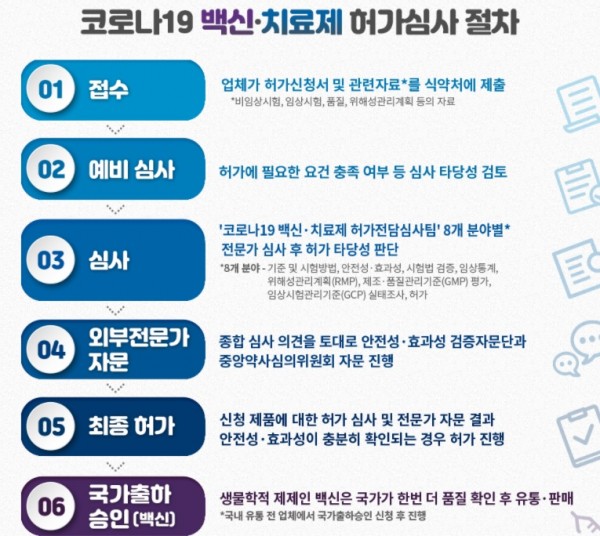
13일 식약처에 따르면 백신 및 치료제 허가를 위한 주요 제출자료는 크게 임상시험 자료, 품질자료 등으로 나눌 수 있다.
임상시험 자료는 사람에게 투여했을 때의 안전성과 효과를, 품질자료는 임상시험에 사용된 의약품이 시판 후에도 동등한 품질로 생산·관리될 수 있는지를 보여주는 자료이다
백신 임상시험은 치료 효과를 보는 일반적인 의약품의 임상평가와 달리, 건강한 사람을 대상으로 백신 접종 후 감염병이 예방되는 효과를 평가하며 단계별로 임상시험을 한다.
임상 1상은 수십 명의 건강한 성인을 대상으로 약물 사용으로 인한 안전상의 중대한 문제가 있는지 확인하는 단계이다. 일반 의약품과 동일한 단계이지만 백신의 경우에는 통상적으로 항원 성분에 대한 면역반응도 탐색한다.
임상 2상은 수십에서 수백 명의 건강한 백신 접종 목표 집단을 대상으로 안전성과 면역원성을 확인한다. 일반 치료제와 달리 백신의 특성상 임상 2상에서도 일반인을 대상으로 임상시험을 실시한다.
참고로 임상 2상은 투여용량이나 투여간격 등을 탐색적으로 확인하는 목적으로 수행되며, 최근에는 임상 3상과 함께 수행하는 것으로 임상이 진행되기도 한다.
임상 3상은 임상 2상에서 결정된 용법·용량을 사용하여 임상 대상 규모를 수천에서 수만 명으로 확대해 허가를 뒷받침할 확실한 임상적 증거를 제공하는 단계이다.
백신의 경우 효과성 평가변수로는 일반적으로 ’감염병 예방 효과(%)‘를 사용한다.
백신은 안전성 평가가 매우 중요해 임상 3상에서 대규모 임상대상자를 대상으로 최소 6개월 이상의 추적관찰 기간을 두어 중대한 이상반응 및 예상하지 못한 이상사례 등 장기 안전성을 평가한다.
식약처는 최신 과학 수준의 국제적 의약품 허가기준을 정하는 국제규제협의체인 ‘국제의약품규제조화위원회(ICH)’의 회원으로, 우리나라의 의약품 허가 요건과 심사기준은 미국·유럽·일본 등 선진국과 동등하다고 밝혔다.
- 이전글올해 2학기부터 「식품안전과 건강」 고교 정규수업에서 가르친다 21.01.15
- 다음글식약처, 코로나19 치료 및 예방효과 허위 광고 판매 집중 점검 21.01.12
댓글목록
등록된 댓글이 없습니다.